Pengertian dan Kurva Titrasi Asam Basa
Apakah kamu sudah tahu apa itu titrasi asam basa? Pastinya di sekolah kamu pun belajar doong tentang titrasi? Nah, pada artikel kali ini kita akan mempelajari pengertian serta kurva titrasi asam basa. Dalam asam basa, besaran yang digunakan adalah kemolaran benda, dan kemolaran menyatakan jumlah mol zat terlarut dari setiap liter larutan.
1. Apa itu Titrasi Asam Basa
Titrasi asam basa merupakan suatu prosedur yang dilakukan saat kita ingin menentukan kemolaran atau kadar suatu asam atau basa berdasarkan reaksi netralisasi. Selain itu, dalam titrasi asam basa terdapat beberapa istilah yang harus kamu ketahui, beberapa istilah di antaranya:
- Pentiter, merupakan zat yang mentitrasi suatu asam-basa yang ingin ditentukan kemolarannya.
- Titik akhir titrasi, merupakan titik saat indikator asam-basa mengalami perubahan warna
- Titik ekuivalen, merupakan titik saat asam-basa tepat habis bereaksi
- Daerah perubahan pH drastis, merupakan daerah di mana saat terjadinya sedikit penambahan tetes pentiter, akan mengubah warna indikator asam-basa
Titrasi asam basa bisa kamu lakukan ketika menggunakan sebuah indikator asam-basa serta zat pentiter. Nah, indikator asam-basa yang baik untuk titrasi itu ada dua macam, yaitu:
- Yang mempunyai trayek perubahan pH yang berada di sekitar titik ekuivalen atau pada titik ekuivalen tersebut
- Ketika perubahan warna terlihat jelas dan juga tajam.
Merupakan porses titrasi. Tidak selalunya basa sebagai pentitrasi, bisa juga sebaliknya,asam yang menjadi pentitrasi
Kemudian, untuk menggunakan indikator asam-basa, kamu harus menggunakan beberapa prosedur titrasi, di antaranya adalah:
1. Asam yang akan dititrasi, mula-mula ditetesi indikator asam-basa secukupnya.
2. Kemudian masukkan pentiter yang berupa basa, setetes demi setetes sambil menghitung.
3. Ketika warna indikator berubah, hentikan titrasi (titik akhir titrasi).
Kamu harus tahu nih bahwa pada titrasi asam-basa terdapat rumus titrasi yang berlaku, yaitu: Asam-basa monovalen dan asam-basa divalen
Ma. Va = Mb. Vb
- Asam divalen-basa monovalen
2. Ma. Va = Mb. Vb
- Basa divalen-asam monovalen
Ma. Va = 2. Mb. Vb
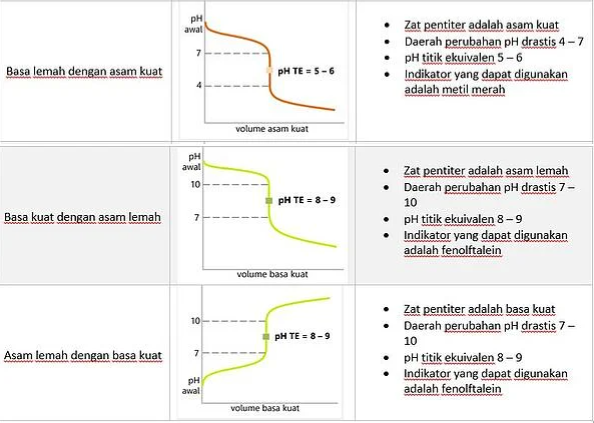
2. Mengenal Kurva Titrasi
Sekarang, kita lihat yuk seperti apa kurva titrasi pada penjelasan tabel di bawah ini.
Kemudian, titrasi asam lemah menggunakan basa lemah dan sebaliknya tidak dilakukan karena:
1. Perubahan pH drastis terjadi sangat singkat.
2. Tidak ada indikator yang cukup teliti untuk mengamati perubahan.
3. Reaksi berlangsung lambat dan tidak tuntas.
Bagaimana? Sekarang kamu sudah mengerti dong apa itu titrasi asam-basa. Melalui proses titrasi, suatu kemolaran dapat kamu tentukan, begitu juga dengan suatu kadar asam-basa. Kamu juga harus perhatikan dan pahami kurva titrasinya ya.
Mengenal Sifat dan Klasifikasi Asam Basa
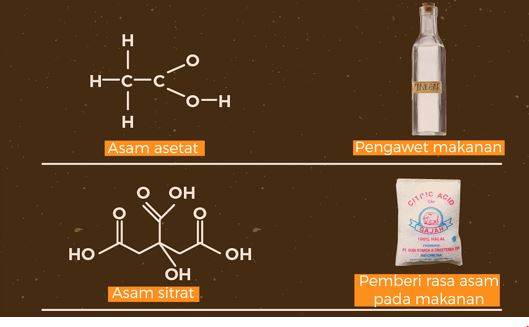
Asam dan basa merupakan dua senyawa kimia yang sangat penting dalam kehidupan sehari-hari kita. Secara umum, zat–zat yang memiliki rasa masam itu mengandung asam, misalnya asam sitrat pada jeruk, asam asetat pada cuka makanan, serta asam benzoat yang digunakan sebagai pengawet makanan.
Kemudian, basa adalah senyawa yang mempunyai sifat licin, rasanya pahit seperti obat dan sabun, kemudian ada beberapa jenis basa yang bersifat korosif (penyebab karat) dan kausatik (merusak kulit).
Meskipun asam dan basa dapat dibedakan dari rasanya, tetapi tidak disarankan lho ya (dilarang) untuk mencicipi asam atau basa yang ada di laboratorium, berbahaya, nanti kamu kenapa-kenapa lagi, soalnya kandungannya itu beda.
Asam dan Basa dapat dibedakan melalui indikator asam basa, yaitu alat penguji asam basa. Larutan asam dan basa dapat diperoleh dengan melarutkan asam atau basa secara langsung ke dalam air. Selain itu, larutan ini juga dapat diperoleh melalui reaksi antara senyawa oksida dengan air.
Reaksi antara oksida asam dengan air akan menghasilkan larutan asam, sedangkan reaksi antara oksida basa dengan air menghasilkan larutan basa. Larutan basa juga dapat dihasilkan dari reaksi antara logam reaktif dengan air.
Oksida adalah senyawa antara unsur tertentu dengan oksigen. Oksida asam adalah oksida yang berasal dari unsur nonlogam dengan oksigen misalnya CO2, SO2, P2O5, Cl2O7 dan sebagainya. Oksida asam jika bereaksi dengan air akan menghasilkan larutan asam.
Oksida basa adalah oksida yang berasal dari unsur logam dengan oksigen, misalnya Na2O, CaO, Fe2O3, dan sebagainya. Oksida basa jika bereaksi dengan air akan menghasilkan larutan basa.Di antara senyawa oksida, ada yang disebut oksida indiferen, yaitu oksida yang tidak dapat membentuk asam maupun basa, misalnya CO dan NO. Selain itu, ada juga oksida amfoter. Amfoter itu dapat bereaksi dengan ion asam (H+) dan ion basa (OH-). Contoh oksida amfoter adalah Al2O3 dan ZnO.
- Asam anion adalah asam yang mempunyai muatan negatif. Contohnya: SO3-
- Asam kation adalah asam yang mempunyai muatan positif. Contohnya: NN4+
- Basa anion adalah basa yang mempunyai muatan negatif. Contohnya: CI-, CN-
- Basa kation adalah basa yang mempunyai muatan positif. Contohnya: Na+, Ca2+
















Semoga bermanfaat bagi semua orang yang sedang lagi belajar.
ReplyDelete